Los resultados del estudio muestran cómo los efectos de la olanzapina dependen de la ruta de administración
Los fármacos antipsicóticos de segunda generación son el tratamiento de elección para personas con esquizofrenia y otras enfermedades mentales. Sin embargo, numerosos estudios han puesto en evidencia efectos secundarios sobre el metabolismo glucídico y lipídico, conducentes al desarrollo de obesidad, resistencia a la insulina y diabetes tipo 2.
Ahora, un nuevo estudio liderado por investigadores del Instituto de Investigaciones Biomedicas Alberto Sols (IIBM) y el CIBERdem, en el que también participan investigadores del Instituto de Investigación Sanitaria La Princesa, el Centro Nacional de Investigaciones Cardiovasculares y la Universidad de Uppsala, ha demostrado diferencias substanciales en la regulación del peso corporal y el balance energético en ratones macho tratados con olanzapina, un fármaco antipsicótico de amplio uso en la clínica.
Los resultados, publicados en la revista Metabolism, muestran cómo los efectos del fármaco dependen de la ruta de administración. Los ratones que recibieron olanzapina suplementada en la dieta, por ejemplo, presentaron hiperfagia, ganancia de peso y disminución del gasto energético. Sin embargo, la administración de una dosis equivalente de este antipsicótico por vía intraperitoneal, provocó que los ratones perdieran peso en paralelo con un aumento del gasto energético.
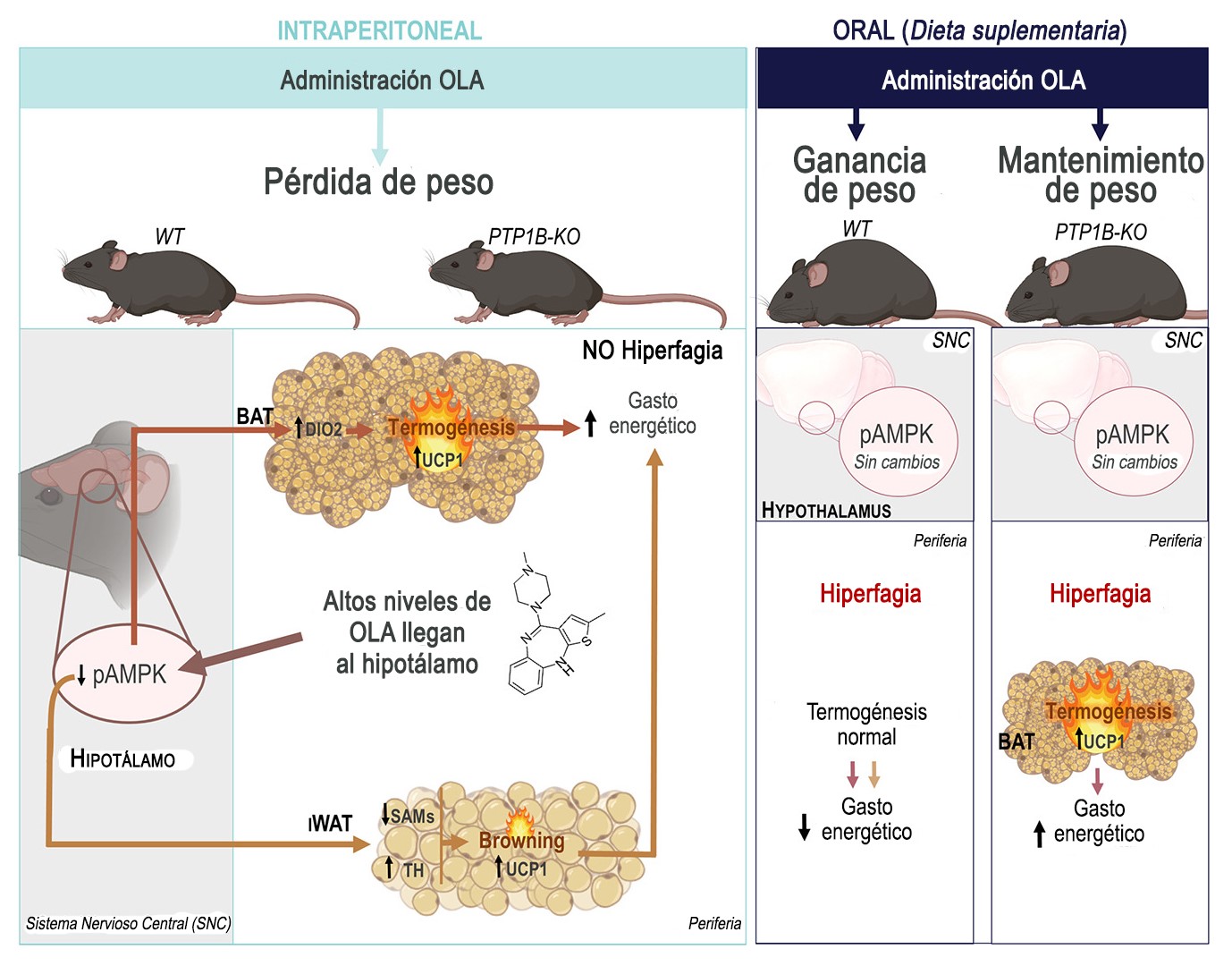
Los resultados del estudio muestran cómo los efectos de la olanzapina dependen de la ruta de administración. Aquellos ratones que recibieron olanzapina suplementada en la dieta presentaron hiperfagia, ganancia de peso y disminución del gasto energético, mientras que la administración de una dosis equivalente de este fármaco por vía intraperitoneal, provocó que los ratones perdieran peso y aumentasen el gasto energético / Ferreira et al.
Cambios moleculares
A nivel molecular, en los ratones tratados con olanzapina vía intraperitoneal, se encontró una disminución de la fosforilación de la proteína quinasa dependiente de AMP (AMPK) en el hipotálamo, que era paralela a un aumento de los niveles de la proteína desacoplante UCP-1 en los tejidos adiposos marrón y blanco subcutáneo inguinal (beige).
En este sentido, ambos depósitos grasos presentaban características histológicas de activación, así como un aumento de la temperatura de la zona del tejido adiposo marrón interescapular y una mayor inervación simpática del tejido adiposo beige.
Estos cambios moleculares también se observaron en ratones que recibieron una inyección intrahipotalámica de olanzapina y, lo que es más relevante, se suprimían en ratones que sobreexpresan una versión constitutivamente activa de AMPK específicamente en el hipotálamo.
Por el contrario, este eje hipotálamo-tejido adiposo marrón/beige no se modulaba en los ratones que recibieron tratamiento con olanzapina por vía oral.
El análisis de los niveles de olanzapina tras la administración de una dosis única por vía intraperitoneal u oral (gavage), reveló un pico del fármaco en plasma e hipotálamo 2.5 veces mayor en los ratones inyectados por vía intraperitoneal.
Estos resultados sugerían que los niveles de olanzapina en el hipotálamo podrían ser determinantes para modular la fosforilación de AMPK en esta región del cerebro y activar de esta manera la termogénesis en los tejidos adiposos marrón y beige.
Al mismo tiempo, los resultados de este estudio han puesto de manifiesto que la inhibición de la proteína tirosina fosfatasa 1B (PTP1B), una diana terapéutica frente a la diabetes y obesidad, confiere protección frente a la ganancia de peso inducida por la administración oral de olanzapina, potenciando la activación del tejido adiposo marrón y aumentando el gasto energético.
Referencia bibliográfica:
Ferreira, V., Folgueira, C., Guillén, M., Zubiaur, P., Navares, M., Sarsenbayeva, A., López-Larrubia, P., Eriksson, J.W., Pereira, M.J., Abad-Santos, F., Sabio, G., Rada, P., Valverde, Á.M. 2022. Modulation of hypothalamic AMPK phosphorylation by olanzapine controls energy balance and body weight. Metabolism 19:155335. doi: 10.1016/j.metabol.2022.155335. Online ahead of print. PMID: 36272468.

