Investigadores de la Universidad Autónoma de Madrid (UAM) y el CSIC han descubierto procesos clave en la sinapsis inmune que abren nuevas posibilidades terapéuticas para tratar enfermedades autoinmunes y mejorar la respuesta de los linfocitos T frente al cáncer
Un equipo español liderado desde la Universidad Autónoma de Madrid (UAM) y por el Consejo Superior de Investigaciones Científicas (CSIC) ha identificado mecanismos esenciales en la sinapsis inmune que podrían abrir nuevas vías terapéuticas, no sólo para tratar enfermedades autoinmunes, sino también para potenciar la respuesta de los linfocitos T contra el cáncer.
El sistema inmunológico humano está compuesto por una amplia variedad de células especializadas, donde los linfocitos T desempeñan una función crucial. Su activación se inicia cuando el receptor de antígenos en los linfocitos T reconoce y se une a antígenos presentados por células especializadas llamadas presentadoras de antígenos, un proceso que desencadena la formación de la sinapsis inmune. Este fenómeno se caracteriza por la reorganización de moléculas de señalización y receptores de adhesión en el sitio de contacto, lo cual facilita una secreción focalizada hacia la célula presentadora de antígenos.
“Los filamentos de actina (F-actina) son elementos esenciales en la creación y reestructuración de la sinapsis inmune. Estos filamentos facilitan la comunicación entre los linfocitos T y las células presentadoras de antígenos. En este proceso, las proteínas llamadas forminas desempeñan un papel clave, ya que contribuyen a la reorganización del citoesqueleto de actina durante la activación de los linfocitos T”, explica Javier Ruiz-Navarro, primer autor del estudio.
Forminas y secreción polarizada en la sinapsis inmune
En particular, ciertas forminas, como Dia1 y FMNL1, son fundamentales en la orientación de la maquinaria secretora del linfocito T hacia la sinapsis inmune. Sin embargo, los mecanismos moleculares que regulan esta secreción polarizada no se comprendían completamente hasta ahora.
La investigación, ha demostrado que la isoforma β de FMNL1 es reclutada de forma transitoria en la sinapsis inmune tras la activación del receptor de antígenos de los linfocitos T, en un proceso independiente de la fosforilación del aminoácido S1086.
“Una vez en la sinapsis, la fosforilación de la isoforma β de FMNL1 en S1086 resulta crucial para dos funciones: la reorganización de la F-actina cortical y la polarización de la maquinaria secretora del linfocito T hacia la sinapsis inmune. Estos dos procesos actúan de forma coordinada para controlar la secreción focalizada de exosomas en la sinapsis”, detalla Ruiz-Navarro.
El estudio, publicado en eLife, ha sido liderado por los equipos de Manuel Izquierdo, Víctor Calvo y Francesc García-Gonzalo del Instituto de Investigaciones Biomédicas Sols-Morreale (IIBM), centro mixto del CSIC y la UAM, y ha contado con la colaboración de investigadores del IdiPAZ, CNIO e ISCIII.
Recurso videográfico
Formación de sinapsis inmunitarias y tráfico polarizado de los cuerpos multivesiculares (MVB) hacia la sinapsis.
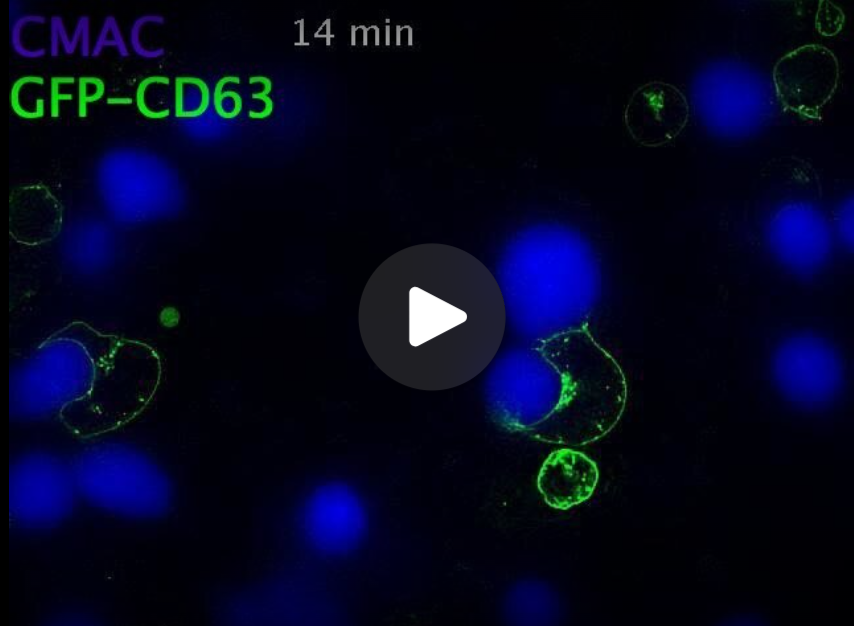
Las células del clon de linfocitos T Jurkat C3 que expresan GFP-CD63 (verde) en vesículas (CD63 es un marcador de los cuerpos multivesiculares-MVB, que son los responsables de la liberación de los exosomas) se mezclaron con células presentadoras de antígeno Raji marcadas con CMAC (azul) pulsadas con enterotoxina E de estafilococo (SEE), previamente unidas a portaobjetos, para inducir la formación de sinapsis inmunitaria. A continuación, se registraron mediante microscopía de fluorescencia la formación de contactos sinápticos entre ambos tipos celulares. El vídeo (7 fotogramas por segundo) muestra una sinapsis ya establecida (centro) y dos sinapsis emergentes (centro izquierda y esquina superior derecha), junto con el movimiento de los MVB (vesículas verdes GFP-CD63+) dentro de las células Jurkat, hacia las zonas de contacto sináptico con las células Raji azules. Se muestran los canales combinados CMAC (azul) y GFP-CD63 (verde). En los primeros fotogramas, toda la superficie celular de las células Jurkat está marcada con GFP-CD63, debido a la fusión previa y multidireccional de los MVB GFP-CD63+ con la membrana plasmática.
Referencia bibliográfica:
Javier Ruiz-Navarro, Sara Fernández-Hermira, Irene Sanz-Fernández, Pablo Barbeito, Alfonso Navarro-Zapata, Antonio Pérez-Martínez, Francesc R Garcia-Gonzalo, Víctor Calvo, Manuel Izquierdo Pastor (2024). “Formin-like 1β phosphorylation at S1086 is necessary for secretory polarized traffic of exosomes at the immune synapse in Jurkat T lymphocytes”, eLife 13:RP96942. https://doi.org/10.7554/eLife.96942.4

