Un equipo del <a href="https://www.cbm.uam.es/en/joomla-rl/index.php/es" title="Centro de Biología Molecular Severo Ochoa" alt="Centro de Biología Molecular Severo Ochoa" target="_blank">Centro de Biología Molecular Severo Ochoa</a> (CMB Severo Ochoa), formado por investigadores de la <a href="http://www.uam.es/UAM/Home.htm?language=es " title="Universidad Autónoma de Madrid" alt="Universidad Autónoma de Madrid" target="_blank">Universidad Autónoma de Madrid</a> (UAM) y el <a href="https://www.csic.es/es" title="Consejo Superior de Investigaciones Científicas" alt="Consejo Superior de Investigaciones Científicas" target="_blank">Consejo Superior de Investigaciones Científicas</a>, (CSIC), ha observado que unas proteínas de unión a RNA inciden en la desregulación de la dinámica y la función mitocondrial, proceso que se asocia a situaciones fisiopatológicas relevantes. El trabajo se publica en <a href="https://journals.asm.org/doi/abs/10.1128/mcb.00174-17" title="Molecular and Cellular Biology" alt="Molecular and Cellular Biology" target="_blank">Molecular and Cellular Biology</a>.
Investigadores del Centro de Biología Molecular Severo Ochoa, centro mixto de la Universidad Autónoma de Madrid (UAM) y el CSIC, han descrito nuevos mecanismos moleculares con los que la mitocondria modula su actividad en las células humanas.
En concreto, el equipo ha demostrado cómo unas proteínas de unión a RNA, implicadas en respuestas de estrés celular (TIA1, TIAR y HuR), son capaces de regular de forma opuesta la dinámica y la función mitocondrial.
La desregulación de la dinámica y la función mitocondrial se asocia a situaciones fisiopatológicas relevantes, que están en la base molecular de patologías humanas tan graves como el cáncer, la diabetes o las enfermedades cardiovasculares y neurodegenerativas.
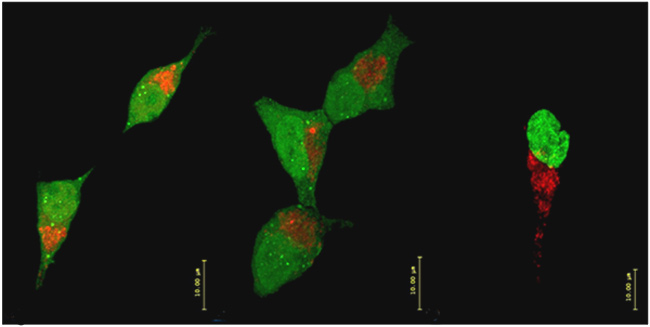
Dinámica mitocondrial en células FT293 con expresión de GFP-TIA1 (izquierda), GFP-TIAR (centro) y GFP-HuR (derecha). Expresión de las proteínas anteriores (en verde) y las mitocondrias (en rojo) teñidas con Mitotracker. Las barras de tamaño representan 10 micrometros. / UAM
"Nuestras observaciones identifican unos actores a través de los que se podría incidir en alguna de estas situaciones para corregir o evitar el desarrollo de fenotipos celulares deletéreos", comenta Isabel Martínez Carrascoso, primera firmante del trabajo.
José María Izquierdo Juárez, director del equipo, detalla sobre las observaciones realizadas: "Identificamos que la expresión de las proteínas TIA1 y TIAR favorece la dinámica de división y agrupamiento de los orgánulos, lo que se acompaña de la pérdida de su función, mientras que HuR promueve la fusión y el remodelamiento interno, lo que favorece una mayor y más eficiente función mitocondrial. En ambos casos y de manera antagónica, la regulación se ejerce a través de la proteína OPA1, un componente vital para la morfología y dinámica externa e interna mitocondrial".
Estos resultados, publicados en Molecular and Cellular Biology, recalcan que en situaciones de estrés la mitocondria desempeña un papel fundamental en la biología y el destino celular, permitiendo a través de su diseño y función la adaptación celular con una única misión: sobrevivir.
CENTRALES ENERGÉTICAS DE LAS CÉLULAS
Las mitocondrias son los orgánulos subcelulares que transforman más eficientemente la energía contenida en los alimentos en energía celular o ATP. Además, son esenciales para muchos otros aspectos del metabolismo (por ejemplo hemo, urea, calcio, etc.), para la detoxificación celular (producción y eliminación de especies reactivas de oxígeno) e incluso para la supervivencia de las células. Por todo esto, su actividad y función se optimiza y adapta a las demandas de los tipos celulares y tejidos que constituyen los organismos.
En condiciones de equilibrio, las mitocondrias se visualizan a través del microscopio como una red o malla que interconecta los orgánulos. Esta red, sin embargo, es muy dinámica, siendo el resultado de continuos fenómenos de fusión y división. Aunque no siempre es la norma, la morfología de red y el remodelamiento interno de las mitocondrias son fundamentales para una mejor y mayor funcionalidad mitocondrial y celular.
Referencia bibliográfica:
Carrascoso, I., Alcalde, J., Sánchez-Jiménez, C., González-Sánchez, P., & Izquierdo J.M. 2017. T-cell intracellular antigens and Hu antigen R antagonistically modulate mitochondrial activity and dynamics by regulating optic atrophy 1 gene expression. Molecular and Cellular Biology. DOI: 10.1128/MCB.00174-17

