Mientras se encuentra algún agente antiviral que elimine el virus o una vacuna que proteja de la infección, las medidas a adoptar son eminente profilácticas: mayor distancia social y extremar la limpieza
La rápida expansión de la pandemia de COVID-19 causada por el virus SARS-CoV2 está suponiendo un cambio en nuestro modo de vida (social, laboral, económica, etc.). Mientras se encuentra algún agente antiviral que elimine el virus o una vacuna que proteja de la infección, las medidas adoptadas por la Organización Mundial de la Salud (OMS) y las autoridades sanitarias son profilácticas: mayor distancia social y extremar la limpieza.
En este contexto, el jabón juega un papel muy importante; como lo ha hecho a lo largo de la historia de la humanidad; especialmente a nivel sanitario desde que, en 1849, Ignaz Semmelweis (1818-1865) descubrió que muchos fallecimientos de parturientas se podían evitar con un buen lavado de manos. Por desgracia, sus ideas no tuvieron una aceptación inmediata y tuvieron que pasar varias décadas hasta que Louis Pasteur (1822-1895) y Joseph Lister (1827-1912) en 1865 demostraron la importancia de una asepsia correcta para evitar infecciones durante la cirugía.
¿Cómo funciona el jabón?
Hay que recordar que lo que limpia es el agua, pero el agua solo disuelve sustancias con cierta polaridad y lo que ensucia nuestras manos, suelos y ropa suelen ser sustancias lipídicas (grasas) insolubles en agua. Lo que hace el jabón es actuar facilitando la interacción entre el agua y la grasa. Las sustancias que provocan este efecto se denominan surfactantes o tensioactivos, que se pueden considerar términos equivalentes.
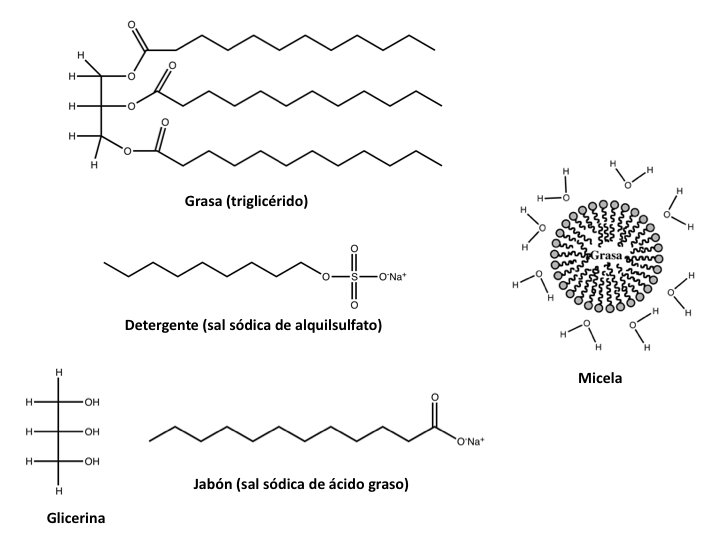
La estructura del jabón (y también de los detergentes, que son sustancias relacionadas) explica su capacidad para facilitar la disolución de las grasas. Las moléculas de lípidos o grasas están formadas por cadenas largas hidrocarbonadas —constituidas por carbono e hidrógeno— unidas a átomos de oxígeno de la glicerina. Estas moléculas —denominadas hidrófobas— repelen el agua. La estructura de la molécula de surfactante está parcialmente relacionada con la de la grasa: tiene una cadena hidrocarbonada larga (la cola) y en el extremo de esta cadena (la cabeza) hay un grupo polar, como puede ser un carboxilato (generalmente en los jabones) o sulfato (en los detergentes). Estos grupos están cargados negativamente (forman sales de sodio o de potasio). El surfactante es capaz de interaccionar con el agua a través de su cabeza polar y por la cola es capaz de interaccionar con las moléculas de lípidos. Por otro lado, el surfactante es capaz de disminuir la tensión superficial del agua (por esta razón se denominan también tensioactivos). Recordemos que la tensión superficial es una propiedad de los líquidos que, de manera indirecta, es una medida de la resistencia de una gota de líquido a interaccionar con otra sustancia.
La interacción del agua con la cabeza polar crea una micela, que es una especie de gota gorda en la que la cadena polar del jabón está apuntando a la superficie de la esfera y que las colas hidrófobas están orientadas hacia el centro. Si hay grasa en el medio, estas quedan ocluidas dentro de las micelas. De esta manera, contactan el agua, el jabón y la grasa.
El jabón frente a los virus y bacterias
Las bacterias y virus poseen una membrana o capa exterior formada por lípidos. Cuando el jabón entra en contacto con estos patógenos disuelve esta capa lipídica, destruyendo la membrana exterior
Las bacterias y virus poseen una membrana o capa exterior formada por lípidos. Cuando el jabón entra en contacto con estos patógenos disuelve esta capa lipídica, destruyendo la membrana exterior. Una vez que esto ocurre, las proteínas que están en la membrana se desnaturalizan porque necesitan los lípidos para mantener su estructura. Y al desestabilizarse, pierden su funcionalidad y esto provoca la muerte de ese organismo.
Aunque hay diferentes surfactantes, la mayoría son similares. Las diferencias entre los jabones de distintos tipos y marcas proceden de los aditivos: suavizantes, agentes hidratantes o abrasivos. Hay que recordar que estos últimos no están presentes en los jabones domésticos y son frecuentes en detergentes para ropa o vajilla. Su papel es mecánico, pues sirven para eliminar suciedad por frotamiento.
Y hablando de esto, hay que recordar que el proceso de lavado de manos también es mecánico, pues al frotar con cierta energía contribuimos a desprender la suciedad.
En estos momentos de crisis sanitaria, muchos pensamos que usar algún tipo especial de jabón, por ejemplo con microbiocidas. Excepto en casos excepcionales, no es necesario usar jabones con biocidas, pues su mal uso puede tener implicaciones negativas. Los componentes de los jabones biocidas suelen ser antibacterianos. Si se abusa de estos, podemos contribuir a crear cepas de bacterias resistentes a los microbiocidas. Frotar bien, con energía y con detenimiento (sin olvidar los huecos entre los dedos) es preferible a usar agentes biocidas.
Otra de las dudas que han surgido últimamente es la dicotomía de elegir entre un lavado de manos con jabón o con un gel desinfectante. En condiciones habituales, un buen lavado de manos es suficiente. Y los geles desinfectantes con un alto contenido de alcohol, generalmente etanol, no son más eficaces que el jabón. La ventaja de estos geles es que no necesitan agua y tampoco material para secar las manos. Por lo que su empleo debería ser solo en circunstancias especiales: fuera de casa, al entrar en hospitales y situaciones similares.
Hay que recordar que estos geles tienen un alto contenido en etanol. Sabemos que podemos consumir algo de etanol, pero no en exceso, pues es neurotóxico y hepatotóxico.
Por supuesto, todo lo expuesto en los párrafos anteriores es para las personas que no tengan tareas en centros sanitarios, pues en estos casos hay que extremar las precauciones.

