Las proteínas relacionadas con enfermedades graves como el cáncer o la diabetes son desordenadas (blandas, amorfas o flexibles), es decir, no se pliegan en estructuras bien definidas y reproducibles
Las regiones de una proteína donde se observa la interacción con un nuevo agente son significativamente más desordenadas (blandas, amorfas o flexibles) que el resto de la proteína. Esto podría facilitar la unión con su nuevo socio, según una investigación de la Universidad Complutense de Madrid y de la Universidad de la Sorbona de París.
Las investigadoras describen en PLOS Computational Biology que, de manera sistemática, cuando una proteína interacciona con otras, DNA o RNA, lo hace precisamente en sus partes más flexibles o blandas antes de tener lugar dicha interacción.
“En nuestro trabajo vemos que los conceptos de desorden y flexibilidad en proteínas, en la parte que concierne a las interacciones, están entrelazados y conllevan un proceso de rigidificación de la proteína”, explica Beatriz Seoane Bartolomé, investigadora del departamento de Física Teórica de la UCM.
Potenciales aplicaciones en farmacia, cáncer o diabetes
Estas conclusiones se extraen de un estudio estadístico combinado de todas las estructuras disponibles actualmente en el Protein Data Bank y, aunque se trata de un estudio a nivel fundamental, abre vías de investigación a nivel práctico en la industria farmacéutica.
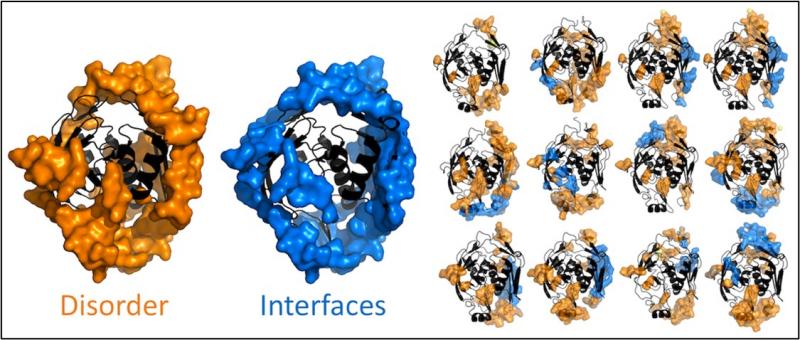
Proteína p53 del Protein Data Bank interaccionando con diversas proteínas y/o ADN formando estructuras diversas. / Alessandra Carbone y Beatriz Seoane.
“Muchos de los fármacos en desarrollo buscan actuar precisamente sobre las superficies de interacción de una proteína para modificar su comportamiento en el cuerpo humano”, apunta Seoane.
Las proteínas relacionadas con enfermedades graves, como el cáncer o la diabetes, son proteínas intrínsecamente desordenadas. “Se entienden mucho peor que las proteínas bien estructuradas, por eso esperamos que nuestro estudio pueda contribuir a su mejor comprensión”, espera la investigadora de la UCM.
Por último, las investigadoras han observado que la localización de este desorden blando en la proteína, va cambiando a medida que esta va aumentando el número de vecinos a los que está unida, “sugiriendo que este desorden blando modula el orden en el que los complejos proteicos se van ensamblando”.
Referencia bibliográfica: Beatriz Seoane y Alessandra Carbone. “The complexity of protein interactions unravelled from structural disorder”. PLOS Computational Biology. Enero 2021. DOI: 10.1371/journal.pcbi.1008546.

