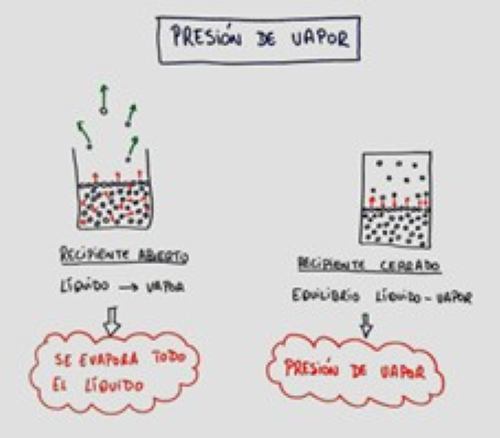
-Cuanta mayor es la presión de vapor de un líquido más fácilmente se evaporará cuando se encuentra en un recipiente abierto.
Sobre una placa de vidrio colocaremos una gota de agua destilada, una gota de alcohol etílico y una gota de acetona. Comprobaremos que la gota de acetona es la primera que se evapora, después el alcohol etílico y por último la gota de agua.
Podemos deducir que el orden de la presión de vapor es el siguiente:
Acetona > alcohol etílico > agua
-Si al líquido se le añade un soluto, su presión de vapor disminuirá y, por tanto, también tardará más en evaporarse.
Prepararemos una disolución de ácido cítrico en alcohol etílico. Colocaremos una gota de alcohol etílico puro sobre una superficie de papel y otra de alcohol con soluto. Comprobaremos que la gota de la disolución tarda más en evaporarse, porque hemos conseguido reducir su presión de vapor.